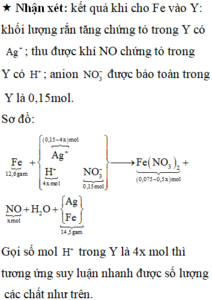
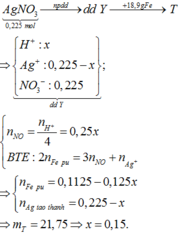Điện phân 225 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 4,02A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 18,9 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 21,75 gam rắn T và khí NO (sản phẩm khử duy nhất của N+5). Phát biểu nào sau đây sai?
A. Chất rắn T thu được chứa 2 kim loại
B. Do Y có chứa HNO3 nên dung dịch sau điện phân có pH<7
C. Trước khi cho sắt vào, nước ở catot chưa bị điện phân
D. Quá trình điện phân được tiến hành trong 5600 giây